En general, se recomienda iniciar el estudio básico de fertilidad tras un año de intento de gestación. Un estudio clásico evaluó que las posibilidades de gestación de las parejas fértiles es de un 20 % al cabo de un mes, y la probabilidad acumulada a lo largo de un año llega al 93 %.
Sin embargo, existen algunos factores que hacen aconsejable iniciar el estudio antes del año. El factor más determinante es la edad de la mujer por su importancia en cuanto a su influencia en la calidad ovocitaria y la reserva ovárica.

El estudio básico debe iniciarse simultáneamente en ambos miembros, puesto que la incapacidad para gestar es un problema de pareja.
*** Según los resultados de las pruebas básicas puede ser que ya se permita plantear un tratamiento a la pareja o bien sean necesarias pruebas complementarias.
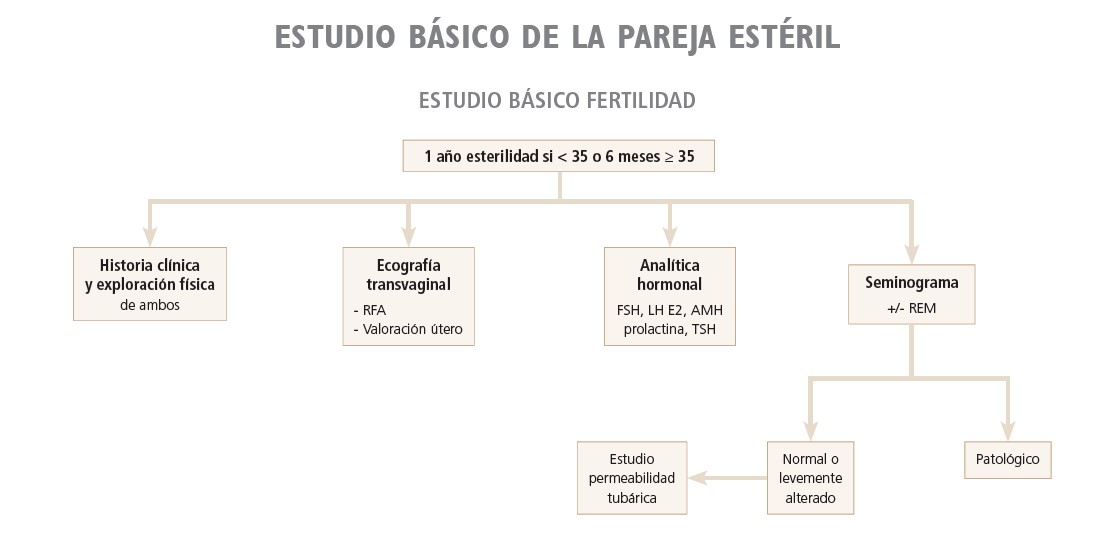
ESTUDIO BÁSICO DE LA MUJER
Anamnesis (historia clínica exhaustiva):
- Antecedentes reproductivos.
- Ciclos menstruales.
- Tiempo de infertilidad.
- Antecedentes médicos y quirúrgicos.
- Medicamentos.
- Alergias.
- Tabaco.
- Alcohol.
- Drogas.
- Antecedentes familiares.
Exploración física:
- Índice de masa corporal.
- Signos de hiperandrogenismo.
- Exploraciones mamaria, abdominal y pélvica.
Marcadores de reserva ovárica.
Analítica hormonal:
- FSH, LH, estradiol (debe realizarse entre el 2º y el 4º día del ciclo).
- Hormona antimülleriana (AMH). Actualmente es el marcador hormonal más fiable de reserva ovárica junto con el recuento de folículos antrales, puesto que no presenta variaciones durante el ciclo y no tiene secreción pulsátil.
- La hormona antimülleriana es una glucoproteína de la familia de los factores de crecimiento, producida por las células de la granulosa de los folículos preantrales y antrales, cuya función es inhibir su desarrollo en las fases iniciales de la foliculogénesis hasta que los folículos alcanzan un tamaño de 4-6 mm y pueden ser seleccionados para la dominancia. Se secreta al líquido folicular y a la sangre, pudiendo determinarse sus valores. Es casi indetectable al nacimiento y tras la menopausia. Sus valores se incrementan gradualmente hasta la pubertad y disminuyen progresivamente cuando se inicia el envejecimiento ovárico.
- En comparación con otras pruebas, tiene la ventaja de que no presenta cambios plasmáticos a lo largo del ciclo ovárico. Su valor predictivo ha adquirido mayor vigencia, y se está introduciendo en la práctica clínica habitual para calcular la dosis inicial de gonadotropinas que deben administrarse en un ciclo de estimulación de la ovulación, valorar la baja respuesta y el riesgo de desarrollar un síndrome de hiperestimulación.
- Sin embargo, a pesar de sus grandes ventajas, los niveles de AMH tienen un valor limitado cuando se determinan en mujeres hiperandrogénicas con ovarios poliquísticos, cuyos niveles pueden modificarse en función de características como la obesidad, el alcohol, el tabaco, la raza y las características étnicas. Cabe recordar al respecto que puede existir hasta un 20 % de variabilidad, dependiendo de la técnica utilizada para su detección (Immunotech-Beckman Coulter vs Diagnostic System Laboratories).
- Con referencia a la baja reserva ovárica, dado que aún no se dispone de una estandarización de los niveles de normalidad de la AHM, su valor no se debería utilizar de forma exclusiva y/o excluyente para tratamientos de estimulación ovárica, sino de forma conjunta con otros marcadores, en orden a poder aconsejar a la pareja sobre sus posibilidades de éxito. Según diversos autores, a pesar de que, como se ha apuntado, no existen valores de normalidad estandarizados, niveles bajos de AHM serían valores entre 0,70 y 0,75 ng/ml y niveles muy bajos valores entre 0,1 y 0,35 ng/ml.
Recuento de folículos antrales:
- TSH y prolactina.
- Recuento de folículos antrales (RFA). Se realiza mediante la valoración ecográfica de los ovarios. A pesar de poder realizarse en cualquier momento del ciclo, es preferible hacerlo justo cuando los ovarios están en reposo, que es en los primeros días de la menstruación. Junto con la HAM, constituye el mejor marcador predictor de reserva ovárica.

Valoración de la cavidad uterina y permeabilidad tubárica:
- Ecografia transvaginal. Permite una valoración de la morfología del útero y de la capa interna o endometrio, donde se produce la implantación. En su caso, pone de manifiesto la existencia de patologías como la presencia de pólipo endometrial, miomas uterinos, malformaciones uterinas.
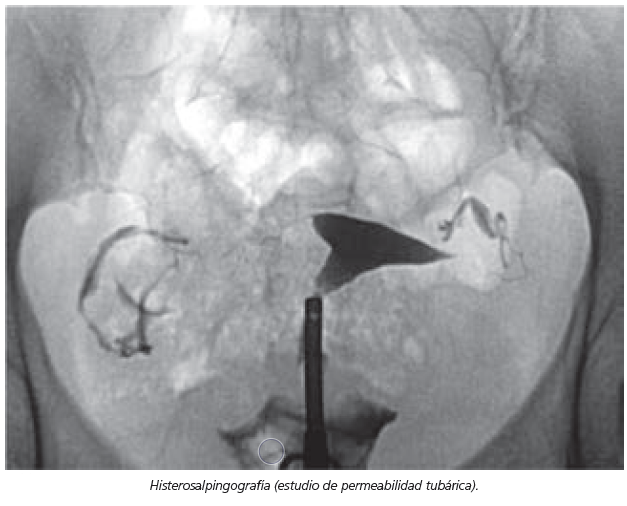
- Histerosalpingografia (HSG). Es la prueba de elección para el estudio de las trompas. Se trata de una prueba que, tras la administración de contraste, permite valorar si existe paso de éste desde las trompas al peritoneo y confirma su permeabilidad. También permite valorar la morfología de la cavidad uterina. Presenta un alto nivel de fiabilidad para la exploración de las trompas, si bien es un procedimiento que tiene algunas limitaciones para asegurar una normalidad tubárica (65 % de sensibilidad y 83 % de especificidad en caso de diagnostico de obstrucción tubárica) y más aún si se trata de valorar el factor tuboperitoneal. Se indicará el estudio de las trompas tras confirmación de semen normal o levemente alterado.
PRUEBAS COMPLEMENTARIAS EN EL ESTUDIO DE LA MUJER
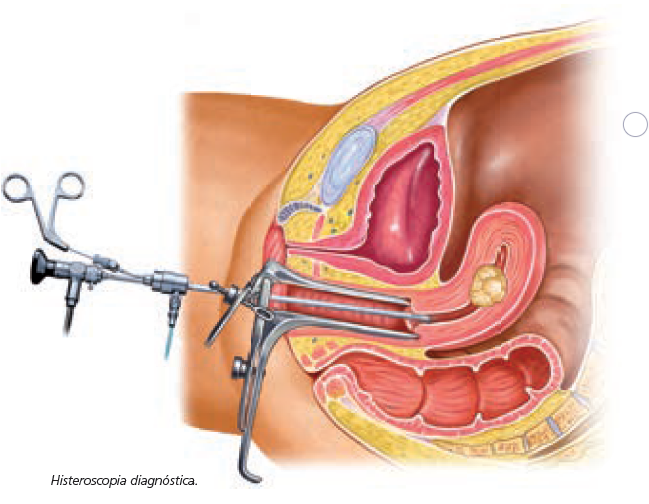
Histeroscopia (HSC)
- Es la técnica más sensible y específica para el estudio de la cavidad uterina, ya que permite el acceso y visualización directa de la misma para evaluar las alteraciones endocavitarias (pólipos, miomas submucosos, adherencias, malformaciones, etc.) y, si es necesario, tratarlas en el mismo acto. También permite el estudio del canal en aquellos casos de cérvix de difícil acceso.
- Su indicación debe ser valorada de forma individualizada, ya que la ecografía transvaginal permite una buena valoración de la cavidad endometrial. Se aconseja la HSC ante la sospecha ecográfica de patología endometrial o en pacientes tras 2-3 fallos de implantación.
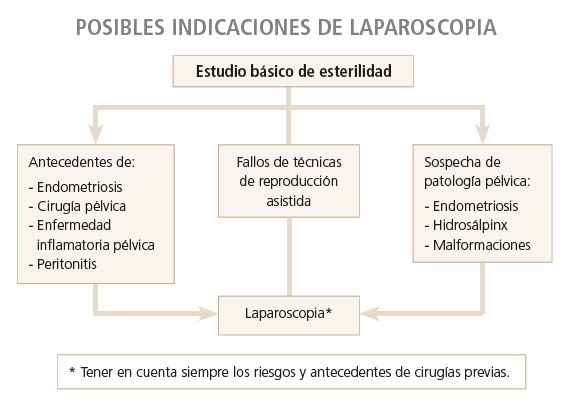
Laparoscopia (LPS)
- Es la técnica diagnóstica más sensible y específica para el estudio de la permeabilidad tubárica, permitiendo una visión directa de la morfología uterina y tubárica, pudiendo además asociarse a una cromoperturbación con azul de metileno. Sin embargo, cabe indicar que, cuando los datos aportados por la HSG y la ecografía pélvica son normales y no existen antecedentes inflamatorios pélvicos ni de enfermedades de transmisión sexual, la LPS no está justificada, ya que es una técnica cara, invasiva, requiere anestesia general y presenta un índice de complicaciones del 2-3 %.
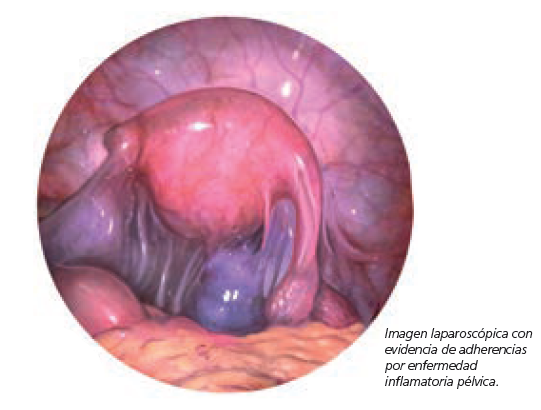
- La LPS es la herramienta indicada si se pretende tratar patologías ya diagnosticadas, como los hidrosálpinxs o los miomas, o bien valorar otras patologías pélvicas que no son accesibles a la ecografía, como las adherencias o las endometriosis mínimas y leves.
- En mujeres infértiles con dolor pélvico crónico o sospecha de factor tubárico (historia de cirugía pélvica, dismenorrea, peritonitis, etc.) o cuando el estudio básico de esterilidad es anómalo (ecografía anormal, serología positiva para Chlamydia, HSG anormal, sospecha de hidrosálpinx, etc.), debe plantearse la indicación de LPS. Si además se añaden fracasos previos de técnicas de reproducción asistida esta indicación todavía es más oportuna.
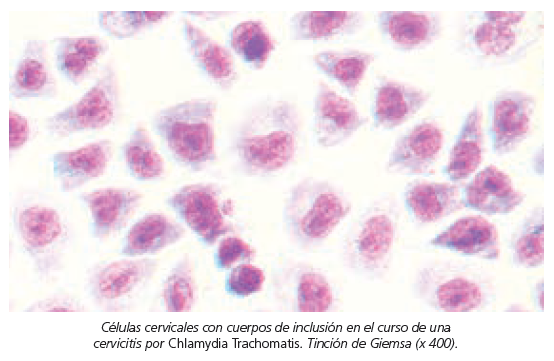
Detección de Chlamydia IgG
- La infección por Chlamydia Trachomatis (CT) es una de las enfermedades de transmisión sexual más frecuentes. En la mayoría de los casos cursa de forma asintomática, pero entre sus secuelas destacan la infertilidad por daño tubárico, un mayor riesgo de embarazo ectópico y unos peores resultados al aplicar las técnicas de reproducción asistida.
- La determinación plasmática de los anticuerpos (Ac) anti-CT permite indirectamente valorar una posible lesión de las trompas, y consecuentemente su obstrucción, secundaria a la infección por este germen.
- Unos valores séricos por encima de 1:256, determinados mediante técnica de análisis de inmunoabsorción ligada a las enzimas (ELISA), se asocia de forma estadísticamente significativa a daño tubárico. El ELISA presenta una especificidad superior al 95 % y una sensibilidad menor del 60 %.
- Sin embargo, su cribado es un tema controvertido y la mayoría de las guías y sociedades científicas no lo recomiendan de rutina, salvo en pacientes que vayan a ser sometidas a instrumentación uterina y en donantes de semen, de óvulos o de embriones. Las limitaciones del cribado de Ac-antiCT son varias: los Ac-antiCT pueden persistir durante años para finalmente negativizarse, lo ensayos serológios son susceptibles de reacciones cruzadas con otras especies de Chlamydia, no detecta otras causas de patología tubárica e incluso puede haber mujeres con Ac (+) que no presenten obstrucción tubárica.
- En caso de realizar cualquier instrumentación uterina, como sería una HSG, debe realizarse un cribado para descartar presencia de CT o, en su defecto, se deberá realizar profilaxis antibiótica con azitromicina o doxiciclina.
- Por el momento, la detección de los Ac-antiCT en parejas estériles no está indicada como cribado, dada la baja prevalencia de la infección (2-5%) y las limitaciones de los test serológicos.
ESTUDIO BÁSICO DEL VARÓN
Anamnesis (historia clínica exhaustiva):
- Antecedentes reproductivos.
- Tiempo de infertilidad.
- Antecedentes médicos y quirúrgicos.
- Medicamentos.
- Alergias.
- Tabaco.
- Alcohol.
- Drogas.
- Antecedentes familiares.
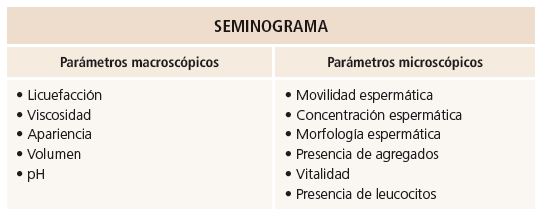
Seminograma
El seminograma es una prueba diagnóstica básica que consiste en analizar múltiples parámetros (macroscópicos y microscópicos) de una muestra de semen.
Abarca dos ámbitos:
- Macroscópico: observación de la licuefacción, viscosidad, apariencia, volumen y pH.
- Microscópico: movilidad espermática, concentración espermática, morfología espermática, presencia de agregados, vitalidad y presencia de leucocitos.
De este modo, analizando todos los parámetros mencionados, se puede determinar el potencial fértil del paciente. No obstante, una muestra de semen que se encuentre dentro de los valores considerados normales, no es sinónimo de una muestra 100 % capaz de producir un niño vivo en casa tras realizar técnicas de reproducción asistida.